Les neurones, cellules bien connue du cerveau communiquent entre eux grâce à la transmission synaptique, la synapse étant l’espace entre 2 neurones. Si l’information d’un bout à l’autre d’un même neurone transite via un courant électrique appelé le potentiel d’action (ou influx nerveux) la transmission synaptique nécessite l’intervention de protéines.
Ces molécules sont sécrétées par les neurones en amont de la synapse et se fixent sur des récepteurs spécifiques portés par le neurone suivant, on les appelle des neurotransmetteurs.
Les neurones dopaminergiques n’utilisent qu’un seul neurotransmetteur pour communiquer entre eux, et avec d’autres types de neurones : la dopamine.
La substance noire située dans le tronc cérébral est une région très petite, de la taille d’une lentille est constituée d’environ 400.000 neurones dopaminergiques. Cette région et les neurones qui la constituent forment un réseau avec d’autres zones cérébrales comme par exemple le striatum, région très impliquée dans le contrôle des mouvements mais aussi dans les fonctions cognitives et comportementales.
Dans la maladie de Parkinson, pour des raisons qui sont encore mal définies, les neurones dopaminergiques meurent progressivement, entraînant une diminution lente du taux de dopamine dans la substance noire mais aussi dans les régions connectées à cette zone.
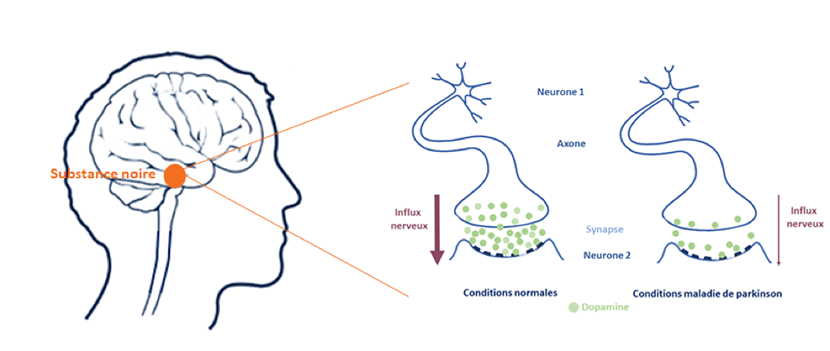
On estime que les 1ers symptômes de la maladie de parkinson apparaissent lorsque 50% des neurones dopaminergiques ont été atteints.
Dans les neurones survivants, on observe des amas d’une protéine particulière l’α-synucléine appelés corps de Lewy. Ces agrégats que l’on retrouve aussi bien dans le corps cellulaire (proche du noyau) que dans les prolongements des neurones (dendrites et axones) sont à l’origine de la mort des neurones et donc de la disparition progressive de dopamine.
Outre les dépôts d’ α-synucléine dans les neurones, on retrouve la protéine dans d’autres types cellulaires et dans l’espace entre 2 neurones (la synapse), ce qui explique la propagation de l’atteinte et la dégénérescence neuronale.
Ainsi on observe des dépôts de la protéine en dehors de la substance noire, en particulier dans le bulbe olfactif, dans le noyau dorsal moteur du vague, dans le complexe Coeruleus-subcoeruleus et dans la moelle épinière chez les patients parkinsoniens.
Il en est de même dans le système nerveux périphérique en particulier les glandes salivaires et certains organes comme le cœur et le tube digestif.
Les agrégats d’ α-synucléine hors de la substance noire expliquent l’hétérogénéité des symptômes « non moteurs » observés chez les patients. Ces symptômes sont aujourd’hui difficiles à traiter mais la découverte récente du rôle clé de l’ α-synucléine ouvre la voie à de nouvelles pistes thérapeutiques.
A l’Institut du Cerveau
Les équipes d’Olga CORTI et du Pr Jean-Christophe CORVOL et de Stéphane HUNOT et Etienne HIRSH travaillent à mieux comprendre les mécanismes moléculaires et cellulaires à l’origine de la maladie de PARKINSON.
Olga CORTI et son équipe cherchent à identifier les conséquences physiologiques des mutations identifiées dans les cas familiaux de la maladie de parkinson, mécanismes qui sont les mêmes chez tous les patients. Cette équipe s’intéresse tout particulièrement au dysfonctionnement des mitochondries, organites dont le rôle est de fournir l’énergie à la cellule et d’assurer sa survie. Le dysfonctionnement des mitochondries semble en effet jouer un rôle important dans la dégénérescence des neurones. En mai 2019, cette équipe a identifié une combinaison de protéines impliquée dans le mécanisme pathologique de la maladie de Parkinson, cette association moléculaire pouvant servir de biomarqueur ou de cible thérapeutique.
L’équipe d’Etienne HIRSH et de Stéphane HUNOT s’intéresse plus particulièrement à la neuroinflammation concomitante à la dégénérescence des neurones dopaminergiques dans la maladie de Parkinson et notamment au rôle des cellules gliales, cellules immunitaires résidentes du cerveau, telles que les astrocytes.






