Le réseau lymphatique méningé, récemment caractérisé, joue-t-il un rôle dans la protection immunitaire du cerveau ?
Ce réseau facilite-t-il l’entrée des cellules immunitaires antigène-spécifiques dans le tissu cérébral ?
Les travaux menés par Eric SONG de l’équipe d’Akiko IWASAKI (département d’Immunologie, Ecole de Médecine de YALE (USA) et Jean-Léon Thomas, chercheur INSERM à l’Institut du Cerveau et de la Moelle épinière* et professeur associé au département de Neurologie de l’Ecole de Médecine de YALE ), permettent d’apporter des réponses à ces questions. Ces travaux sont publiés dans la prestigieuse revue scientifique « NATURE ».
L’équipe collaborative américano-française a montré un rôle bénéfique du réseau vasculaire lymphatique méningé dans le traitement à court et à plus long terme des Glioblastomes Multiforme (GBM).
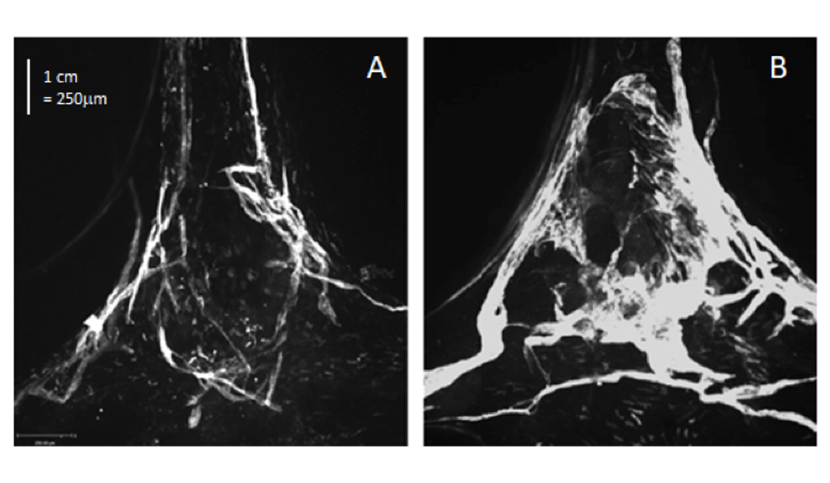
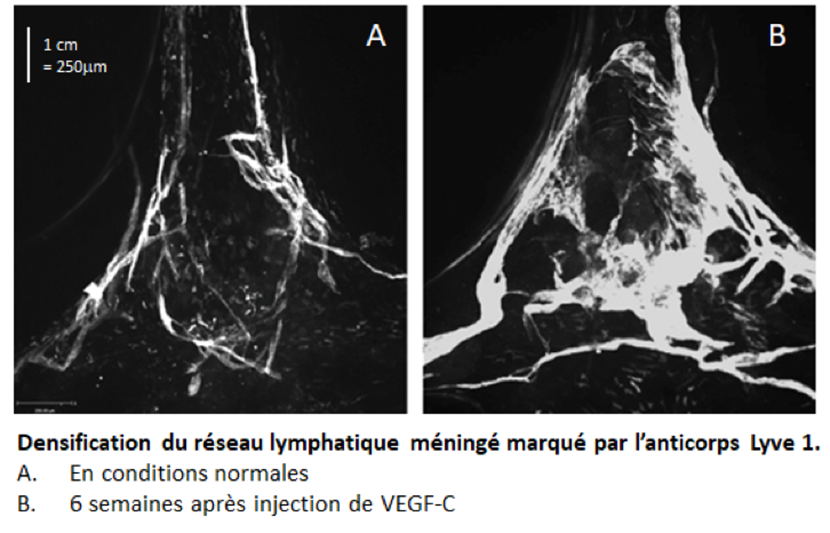
Les chercheurs ont utilisé un modèle expérimental de GBM, la tumeur cérébrale la plus fréquente et la plus grave, dans lequel un rejet de la tumeur a été observé après traitement avec un facteur de croissance spécifique des vaisseaux lymphatiques, le VEGF-C (Vascular Endothelial Growth Factor – C). Le développement du réseau lymphatique méningé, induit par le VEGF-C a été corrélé à une entrée massive de lymphocytes T CD4 et CD8, absents dans des conditions normales, dans l’environnement de la tumeur. Ces réponses à court terme s’accompagnent d’une persistance de cellules immunitaires ‘mémoires’ spécifiquement dirigées contre les cellules tumorales, permettant le rejet de la même tumeur à plus long terme.
Si les lymphocytes CD8 cytotoxiques attaquent et provoquent la régression rapide de la tumeur, les auteurs ont montré que l’infiltration lymphocytaire intracérébrale est la conséquence d’une amplification de la réponse immunitaire à la périphérie du cerveau, dans les ganglions lymphatiques connectés aux vaisseaux lymphatiques méningés. Les ganglions lymphatiques cervicaux sont le site d’activation des lymphocytes T spécifiques de la tumeur, mécanisme provoqué par l’arrivée depuis les méninges de cellules immunitaires qui présentent l’antigène tumoral (cellules présentatrices d’antigène). Renforcer le réseau des vaisseaux lymphatiques méningés permet d’augmenter le trafic des cellules présentatrices de l’antigène tumoral depuis les méninges vers les ganglions lymphatiques. Les auteurs concluent que le rôle majeur du réseau lymphatique méningé serait de transporter, depuis les méninges, le message d’alerte immunitaire déclenchant l’activation des lymphocytes dirigés contre la tumeur.
Les chercheurs ont également montré une synergie d’effet anti-tumoral entre le VEGF-C et une immunothérapie avec l’anticorps monoclonal anti-PD-1, traitement déjà utilisé en neuro-oncologie.
Les résultats de ces travaux ouvrent de nouvelles perspectives dans le traitement des tumeurs cérébrales en ciblant les vaisseaux lymphatiques méningés et leurs ganglions associés, avec d’une part un effet immédiat sur la tumeur et d’autre part un effet à plus long terme par réactivation des lymphocytes mémoires circulants.
Eric Song1, Tianyang Mao1, Huiping Dong1, Ligia Simoes Braga Boisserand2, Salli Antila5, Marcus Bosenberg1,3,4, Kari Alitalo5, Jean-Leon Thomas2,6,8*, Akiko Iwasaki1,3,7,8*
1 Department of Immunobiology, Yale University School of Medicine, New Haven, CT, 06520, USA.
2 Department of Neurology, Yale University School of Medicine, New Haven, CT, 06520, USA.
3 Department of Dermatology, Yale University School of Medicine, New Haven, CT, 06520, USA.
4 Department of Pathology, Yale University School of Medicine, New Haven, CT, 06520, USA.
5 Translational Cancer Medicine Program and Wihuri Research Institute, Biomedicum Helsinki, University of Helsinki, FIN-00014, Helsinki, Finland
6 Institut du Cerveau et de la Moelle Épinière, INSERM U1127, CNRS UMR 7225, GH Pitié-Salpêtrière, Sorbonne Université, 75013 Paris, France
7 Howard Hughes Medical Institute, Chevy Chase, MD, 20815, USA
8 These authors jointly supervised this work: Jean-Leon Thomas, Akiko Iwasaki
*e-mail: jean-leon.thomas@yale.edu, akiko.iwasaki@yale.edu