Le Pr Bruno Stankoff, co-directeur de l’équipe « La remyélinisation dans la sclérose en plaque : de la biologie à la translation clinique » développe de nouveaux outils d’imagerie basés sur la combinaison de l’imagerie par résonnance magnétique (IRM) et de la tomographie par émission de positrons (TEP) afin de mieux comprendre les mécanismes biologiques qui conduisent à la dégénérescence des neurones et à l’installation du handicap dans la sclérose en plaques. A l’occasion de la journée mondiale dédiée à cette maladie nous vous proposons d’en savoir plus sur la tomographie par émission de positons (TEP) et les espoirs qu’elle suscite pour de nouvelles approches thérapeutiques.
La tomographie par émission de positons (TEP) repose sur l’injection intraveineuse d’une substance (le « traceur ») marquée par un atome radioactif, le fluor 18 ou le carbone 11, qui, en se fixant sur les cellules cibles émet des particules particulières, les positons. Ces particules percutent alors les électrons engendrant une émission de photons (particules de lumière). Le traceur est choisi pour se fixer sur un organe ou un tissu spécifique permettant de reconstituer une image de l’organe étudié, en l’occurrence dans la SEP, le cerveau. Les substances radioactives utilisées pour une TEP sont sans danger pour l’homme, la radioactivité très faible disparait totalement en 1 journée.
Cette technique permet de visualiser directement in vivo et en temps réel, la cinétique et la répartition des radiotraceurs injectés et donc celles des molécules auxquels ils se fixent. Elle est couramment associée à une IRM réalisée par la même machine afin d’avoir des images plus précises des organes étudiés.
Dans la sclérose en plaque il est admis que la mort des neurones engendre la progression du handicap au cours des phases progressives de la maladie. Cependant il a été montré que cette neurodégénérescence commence dès le début de la maladie avant même l’apparition des symptômes sans que l’on connaisse encore aujourd’hui les mécanismes biologiques mis en jeu. Il est donc crucial de comprendre les causes de la mort neuronale afin d’identifier des marqueurs biologiques précoces fiables et accessibles pour développer de nouvelles thérapies capables de stopper ce processus avant l’installation d’un handicap irréversible.
Malgré les nombreux progrès technologiques de l’IRM ces dernières années, et l’étude de tissus cérébraux post-mortem, il est encore impossible de différencier les mécanismes à l’origine de la neurodégénérescence, qui dans le cas de la SEP peuvent être nombreux.
La technique de PET, couplée à l’IRM permet de quantifier chaque composant biologiques et donc d’identifier les mécanismes sur ou sous activés et la chronologie des dysfonctionnement au cours des premières phases de la maladie.
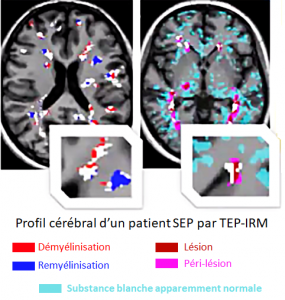
La sclérose en plaques est une maladie complexe qui met en jeu plusieurs processus biologiques pathologiques qui interagissent pour aboutir à des symptômes variant d’un patient à l’autre mais aussi chez un même patient au cours de la maladie.
De plus c’est une pathologie qui affecte non seulement des régions localisées du cerveau, les plaques, mais qui présente un caractère diffus dans tout le tissu cérébral, dans les substances blanche et grise* dites « apparemment normales ».
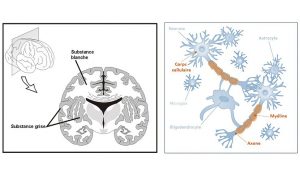
*La substance blanche est principalement composée des axones myélinisés des neurones. La substance grise contient les corps cellulaires des neurones.
Les principaux mécanismes et acteurs biologiques de la maladie sont :
Ø La neuro-inflammation qui résulte de l’activation de l’immunité innée et adaptative.
· L’immunité adaptative principalement médiée par les lymphocytes, est spécifique d’un antigène et donc d’une maladie. Elle est supposée jouer un rôle crucial dans l’initiation de l’inflammation et de la démyélinisation.
· L’immunité innée est non spécifique d’antigène, et est médiée par les macrophages et par les cellules gliales résidentes du cerveau, la microglie et les astrocytes.
Le rôle des astrocytes dans l’inflammation et dans la neuro-dégénération est encore mal connu. La microglie joue un rôle important dans la démyélinisation et est impliqué dans les phases chroniques progressives de la maladie.
Ø La démyélinisation (dégradation de la myéline) et la remyélinisation (réparation de la myéline) est un mécanisme secondaire à l’inflammation. La myéline est une structure membranaire qui entoure l’axone : elle joue un rôle dans la protection du neurone et accélère la transmission de l’influx nerveux.
· La dégradation de la myéline (démyélinisation) est secondaire à une réaction autoimmune, c’est-à-dire que la microglie s’attaque à une protéine du soi et à des cellules de l’organisme, les oligodendrocytes.
· La réparation (remyélinisation) est un processus spontané apparaissant dans certaines lésions chez certains patients. Ce sont les oligodendrocytes qui reforment une gaine autour des axones.
Ø La neuro-dégénérescence correspond à une mort des axones et des neurones : elle est à l’origine du handicap irréversible qui peut s’installer au fur et à mesure de la maladie
Cette dégénérescence neuronale peut être consécutive à la perte de la gaine de myéline qui ne protège plus le neurone en lui fournissant un support métabolique.
Un autre mécanisme associé à la mort des neurones est lié à un dysfonctionnement des mitochondries, petits organites présents dans le corps cellulaire qui permet le métabolisme des nutriments comme le glucose, nécessaires à la survie des cellules et à leur approvisionnement en oxygène et en énergie.
Dans les lésions de sclérose en plaques il a été constaté un dysfonctionnement des mitochondries qui entraine une diminution forte du métabolisme de ces cellules et entraine leur mort par « hypoxie » c’est-à-dire un manque d’oxygène.
Il existe donc plusieurs mécanismes biologiques clés, potentiellement intriqués entre eux, à l’origine de la neurodégénérescence des neurones, observée dans la sclérose en plaques. Les chercheurs de l’Institut du Cerveau ont pour objectif de mieux les comprendre grâce à la technique de TEP-IRM.
Des radiotraceurs ont été développés pour suivre certains mécanismes biologiques impliqués dans la sclérose en plaques comme l’activation des cellules immunitaires et la remyélinisation. Cependant il faut encore faire des recherches pour développer des traceurs spécifiques des types cellulaires et de l’état d’activation des cellules comme la microglie qui alterne des états pro et anti-inflammatoire. Le développement d’un nouveau radiotraceur peut prendre autant de temps que celui d’un médicament car il doit répondre à des critères stricts de taux de pénétration dans le cerveau, de spécificité de la cible visée et surtout d’innocuité chez l’humain.
Cependant, aujourd’hui cette technologie reste un atout majeur pour les recherches sur les mécanismes biologiques de la SEP et l’identification de cibles thérapeutique ouvrant de nouveaux espoirs pour les patients.
Pour en savoir plus :
La TEP-IRM a été acquise par l’IHU A-Institut du Cerveau – ICM (Institut des Neurosciences Translationnelles de Paris), grâce à la Fondation pour la Recherche sur la maladie d’Alzheimer (sous l’égide de la FRM) et à la générosité du Groupe Dassault, de la Fondation Bettencourt Schueller, de la Fondation des Gueules cassées, de la Fondation « The Conny-Maeva Charitable Foundation » et de l’Etablissement Simonetta et a été la premiere en France destiné à la fois à une activité de recherche et de clinique.







