Une étude menée par Irini Kessissoglou dans l’équipe « Développement du cerveau » dirigée par Bassem Hassan (Inserm) à l’Institut du Cerveau (Inserm/CNRS/Sorbonne Université) à l’Hôpital Pitié-Salpêtrière AP-HP, révèle de nouvelles fonctions pour l’homologue de la protéine précurseur amyloïde (APP) chez la drosophile. Les résultats sont publiés dans PLOS Biology.
La protéine précurseur amyloïde (APP) est une protéine essentielle, mieux connue pour son implication dans la voie à l’origine du bêta-amyloïde, composant de la principale lésion de la maladie d’Alzheimer, les plaques amyloïdes. Les mutations du gène APP sont liées à des cas familiaux de maladie d’Alzheimer à début précoce. Cependant, le rôle physiologique de l’APP dans le fonctionnement du cerveau adulte, et l’existence d’un lien entre ce rôle normal et les anomalies observées dans cette pathologie restent incertains. Pour résoudre ce problème, Kessissoglou et al. ont étudié la fonction de cette protéine chez la mouche du vinaigre, drosophila melanogaster, un organisme modèle souvent utilisé dans la recherche biomédicale et qui possède un homologue de l’APP, appelé APPL (Amyloid precursor protein like).
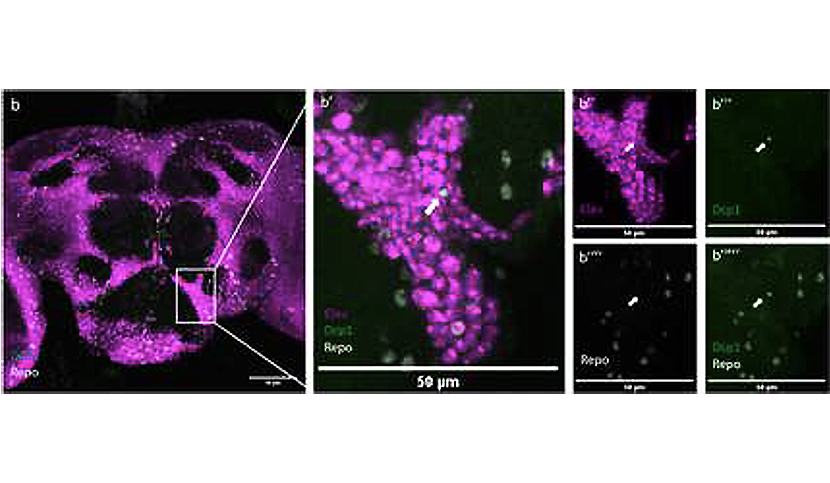
Les neurones, comme toutes les cellules, possèdent un système appelé voie de recyclage et de dégradation endolysosomale pour séparer, recycler et, si nécessaire, mettre à la casse ses protéines. Ce système garantit l’équilibre entre les protéines et les organites des neurones. De plus, celui-ci est défectueux dans les neurones humains présentant des mutations de patients atteints de la maladie d’Alzheimer, ce qui suggère que l’APP peut être importante pour ce processus dans des conditions normales.
En utilisant le modèle de la drosophile avec une perte de fonction de l’APPL, les auteurs ont exploré les mécanismes moléculaires et cellulaires sous-jacents à l’homéostasie du cerveau, qui peut être définie comme les processus physiologiques nécessaires pour maintenir la santé du cerveau et rétablir l’équilibre en cas de blessure ou de maladie.
Ils ont identifié une voie cruciale pour l’homéostasie impliquant APPL. En effet, la perte de fonction de l’APPL entraîne une perturbation de la fonction endolysosomale des neurones, suivie de la mort cellulaire. Les cellules neuronales mortes, qui sont considérablement augmentées avec la perte de APPL, s’accumulent dans le cerveau à un âge précoce. De plus, les mouches dépourvues de APPL ont non seulement une durée de vie plus courte et une neurodégénérescence à l’âge de 30 jours (un âge moyen/avancé à l’échelle d’une drosophile), mais leur cerveau montre également des signes d’homéostasie dysfonctionnelle dès l’âge de 7 jours.
Un point clé de l’étude est la preuve que le domaine extracellulaire de l’APPL sécrété par les neurones interagit avec les cellules gliales pour réguler leur voie endolysosomale et permettre l’élimination des débris neuronaux. Les cellules gliales sont des éléments clés de l’homéostasie du cerveau car elles sont impliquées dans la réponse immunitaire, fournissent des nutriments aux neurones et éliminent les déchets cellulaires. Globalement, cela suggère que l’APPL fait partie d’un système de signalisation neuro-gliale chargé de surveiller la santé du cerveau.
Les résultats de cette étude apportent de nouvelles perspectives sur le rôle de APP dans un contexte physiologique et soulignent son importance pour l’homéostasie du cerveau adulte. Les conclusions concernant les conséquences de la perte de l’APP suggèrent un lien étroit entre ses fonctions physiologiques et les défauts observés dans les cas familiaux de maladie d’Alzheimer. Les premiers effets observés chez les mouches dépourvues d’APPL soutiennent l’idée de modifications à long terme dans le cerveau se produisant avant l’apparition des symptômes cliniques, suggérant de nouvelles recherches sur les endosomes précoces et les interactions neuro-gliales dans cette maladie.
Kessissoglou IA, Langui D, Hasan A, Maral M, Dutta SB, Hiesinger PR, Hassan BA.PLoS Biol. 2020 Dec 8