Catherine Lubetzki (Sorbonne-Université/APHP), Nathalie Sol- Foulon (CNRS) et Anne Desmazières (INSERM), de l’équipe « LA REMYÉLINISATION DANS LA SCLÉROSE EN PLAQUE : DE LA BIOLOGIE À LA TRANSLATION CLINIQUE » à l’Institut du Cerveau, font un point sur les connaissances des noeuds de Ranvier, ces éléments indispensables à la transmission de l’influx nerveux, dans une revue publiée dans Nature Reviews Neurology.
Notre histoire débute par un élément indispensable de notre système nerveux, la myéline. La myéline est une membrane constituée en majorité de lipides qui entoure les prolongements de nos neurones, les axones. Elle agit comme une gaine isolante autour de ceux-ci permettant une diffusion optimale de l’influx nerveux aussi appelé potentiel d’action entre les neurones.
Lorsque le neurone est activé, un échange d’ions sodium et potassium entre l’intérieur et l’extérieur de l’axone provoque un changement de polarité qui crée alors un courant électrique, le potentiel d’action. Ce dernier se propage le long de l’axone jusqu’aux terminaisons nerveuses où il est transmis à d’autres neurones connectés par des synapses.
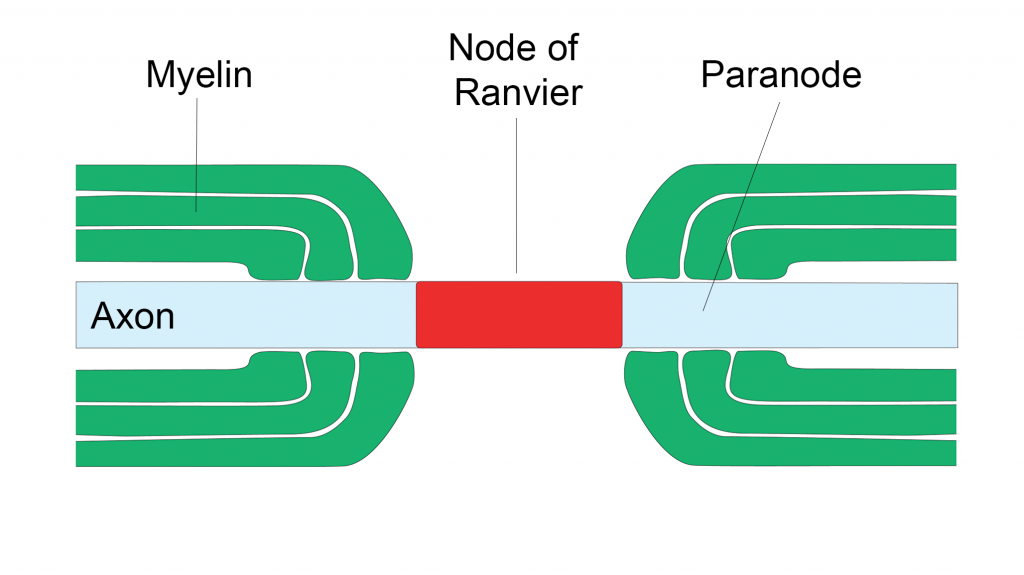
La myéline n’est pas une enveloppe continue. Elle est en réalité composée de segments interrompus par des zones non-myélinisées : les nœuds de Ranvier.
 Les nœuds de Ranvier, qu’est-ce que c’est ?
Les nœuds de Ranvier, qu’est-ce que c’est ?
Les nœuds de Ranvier, ces petits domaines intercalés entre les segments de myéline sont indispensables à la propagation de l’influx nerveux. Ils concentrent des canaux ioniques assurant les flux d’ions sodium et potassium nécessaires à la transmission du potentiel d’action qui s’effectue par des bonds de nœud en nœud. C’est ce qu’on appelle la conduction saltatoire. La gaine de myéline est là pour éviter une déperdition entre chaque nœud et accélérer la diffusion de l’influx. Au fil des années, d’autres rôles essentiels pour les nœuds de Ranvier ont été mis en évidence et soulèvent encore de nombreuses questions.
Plus qu’accélérer la transmission de l’influx, ils la régulent…
Les paramètres morphologiques des axones, leur diamètre, l’épaisseur de la myéline, ou encore la distance entre chaque nœud, sont critiques pour la vitesse de conduction de l’influx nerveux et pourraient être modulés par l’activité électrique des neurones elle-même. Ce processus dynamique s’avère essentiel pour renforcer et synchroniser les circuits neuronaux, et ainsi améliorer les performances de notre système nerveux lors de l’apprentissage. Les nœuds, par leur taille et leur diamètre pourraient également agir comme des régulateurs de la vitesse de conduction. Des différences ont par exemple été identifiées entre les axones du nerf optique et ceux de la substance grise du cerveau. En modifiant ces caractéristiques, les axones pourraient ainsi adapter leur vitesse de conduction de l’influx pour optimiser l’intégration et le traitement des informations.
Une plaque tournante d’interactions cellulaires dans le cerveau
Au niveau des nœuds de Ranvier, des contacts s’établissent avec les cellules de leur environnement, les cellules gliales. Avec les astrocytes, les cellules nourricières et de support du cerveau, avec les précurseurs des oligodendrocytes, les futures cellules productrices de myéline, ou encore avec les cellules microgliales, en charge des défenses immunitaires. Le rôle de ces multiples interactions reste encore à élucider mais celles-ci suggèrent que les nœuds puissent être essentiels à la communication entre neurones et cellules gliales.
L’enjeu des maladies démyélinisantes
L’atteinte des nœuds de Ranvier au cours de maladies démyélinisantes comme la sclérose en plaques est au cœur des recherches depuis de nombreuses années. Une perturbation des nœuds a été identifiée dans des modèles expérimentaux de pathologies inflammatoires démyélinisantes du système nerveux central. Elle est associée à une redistribution des canaux responsables des échanges d’ions sodium et potassium, ce qui affecte à la fois l’intégrité de l’axone en lui-même et la propagation du potentiel d’action.
Dans la sclérose en plaques, les altérations des nœuds semblent être corrélées avec l’activation du système immunitaire dans le système nerveux central. L’inflammation qui résulte de cette activation pourrait alors participer à la désorganisation des nœuds avant même la destruction de la gaine de myéline.
Les nœuds de Ranvier sont ainsi un site privilégié de déclenchement des dysfonctionnements neuronaux dans les maladies démyélinisantes. Ils représentent donc une cible importante pour de futures thérapies neuro-protectives.
Dans la remyélinisation, les nœuds ont aussi un rôle à jouer
La reformation des nœuds de Ranvier a été démontrée dans le processus de restauration de la myéline. Ces nœuds nouvellement formés présentent des caractéristiques spécifiques des axones remyélinisés. Leur fonctionnement et leur rôle exact au cours de la remyélinisation reste cependant à déterminer. Sont-ils directement impliqués dans la conduction de l’influx ou participent-ils d’abord à la bonne formation et localisation des nouvelles gaines de myéline ?
La recherche des mécanismes mis en jeu pour rétablir les nœuds de Ranvier lors de la remyélinisation devient alors essentielle pour développer de nouvelles stratégies pour promouvoir celle-ci.

Photographie d’une image de cervelet : les nœuds sont en rouge, les paranoeuds en blanc et la myéline en vert.
|
Pourquoi nœuds de « Ranvier » ? Les nœuds de Ranvier ont été décrits pour la première fois par Louis-Antoine Ranvier au Collège de France en 1871. Ce scientifique mit en évidence des interruptions dans la gaine de myéline mais leur attribua d’abord un rôle mécanique de conservation de la structure de la myéline autour des fibres nerveuses. |
Source :
Nodes of Ranvier during development and repair in the CNS.
Lubetzki C, Sol-Foulon N, Desmazières A. Nat Rev Neurol. 2020 Jul 10. doi: 10.1038/s41582-020-0375-x. Online ahead of print.PMID: 32651566






