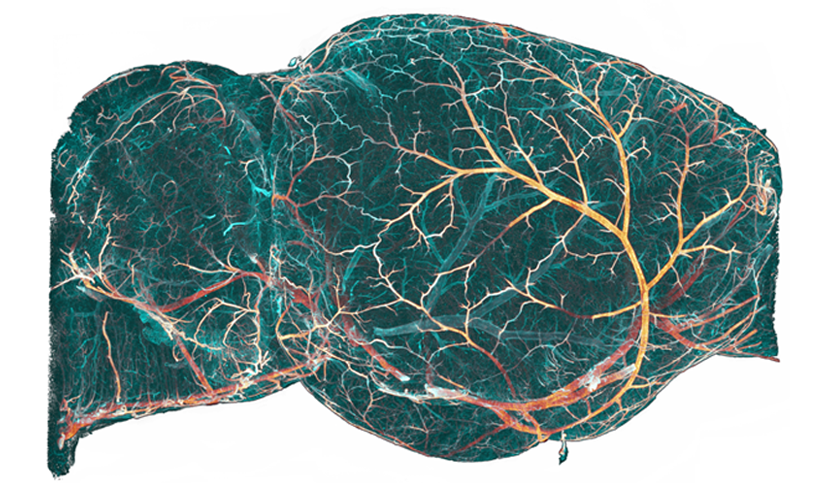
L’équipe de Nicolas Renier à l’Institut du Cerveau et de la Moelle épinière (Inserm/CNRS/Sorbonne Université) à l’hôpital de la Pitié-Salpêtrière AP-HP est parvenue à reconstruire avec une précision encore jamais atteinte le système vasculaire cérébral de la souris dans son intégralité. Alors que de nombreuses pathologies neurologiques et psychiatriques possèdent une composante vasculaire, celle-ci est encore trop peu étudiée du fait de la complexité du réseau de vaisseaux sanguin entremêlé intimement avec les cellules neurales. L’outil développé par les chercheurs ouvre la voie à d’importantes recherches sur le rôle de la vascularisation cérébrale dans l’évolution de nombreuses maladies du cerveau. Les résultats de cette étude sont publiés dans la revue Cell.
Pour répondre à ses besoins importants en oxygène et nutriments, le cerveau est très richement vascularisé en veines, artères et capillaires sanguins. Le système vasculaire cérébral joue un rôle essentiel dans la fonction et le maintien en vie des circuits neuronaux. De nombreuses pathologies du cerveau, neurodégénératives comme neuropsychiatriques (schizophrénie, autisme ou dépression), possèdent une composante vasculaire qui, sans être nécessairement à l’origine de ces maladies, peut être un facteur aggravant de celles-ci. L’étude du système vasculaire cérébral dans son ensemble représente un défi de taille, de par sa densité et sa complexité, mais aussi une opportunité car sa reconstruction 3D complète est maintenant possible.
Mission accomplie pour l’équipe de Nicolas Renier à l’Institut du Cerveau. Grâce à la combinaison d’experts en mathématiques (Christophe Kirst et Sophie Skriabine) et en neurobiologie (Alba Vietes-Prado et Thomas Topilko), les chercheurs sont parvenus à reconstruire l’intégralité du système vasculaire cérébral de la souris à très haute résolution avec une reconnaissance automatique de la nature de chaque vaisseau (artère, capillaire ou veine). Depuis la conclusion de cette étude, plusieurs dizaines de cerveaux ont été reconstruits, car la technique permet d’accélérer et de faciliter l’obtention de ces données. Alors que de telles reconstructions pouvaient prendre plusieurs mois ou années de travail manuel par cerveau auparavant, les chercheurs peuvent maintenant reconstruire un cerveau en 2 jours seulement.
Pour accomplir cela, ils ont mis au point une méthode de marquage biologique permettant de distinguer les artères, veines et capillaires sanguins dans un cerveau rendu optiquement transparent afin d’en enregistrer des images en trois dimensions grâce à une technique d’imagerie de dernière génération, la microscopie en feuillets de lumière. Toutes ces données brutes très complexes de la vasculature cérébrale sont ensuite passées entre les mains des mathématiciens qui ont développé les logiciels permettant de reconstruire ces images grâce à des approches innovantes combinant des mathématiques formelles et des réseaux neuronaux artificiels (neuronal networks).
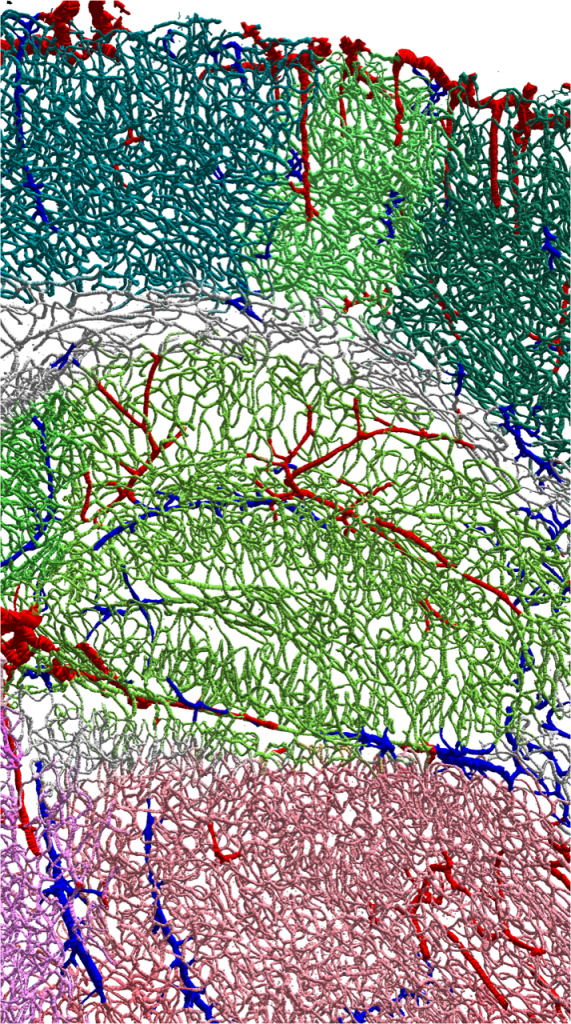
Détail d’une reconstruction automatisée d’un réseau vasculaire cérébral, au niveau de l’hippocampe, montrant les artères en rouge, veines en bleu, capillaires corticaux en vert foncé, capillaires hippocampiques en vert clair, et enfin capillaires thalamiques en rose.
Le résultat est une reconstruction mathématique tridimensionnelle du système vasculaire cérébral, distinguant les différents types de vaisseaux sanguins, leur localisation et leur organisation dans les différentes régions du cerveau. A l’échelle d’un cerveau de souris (environ 1cm3), cela représente près de 280m et quelques 8 millions de vaisseaux avec des variations régionales majeures en termes de densité de vaisseaux, très importante dans les régions sensorielles par exemple.
« Ces reconstructions mathématiques sont très reproductibles dans différents modèles et conditions. Elles ouvrent la porte à de nouvelles hypothèses de travail et opportunités, notamment dans l’étude de différentes pathologies, mais aussi pour comprendre l’organisation intime du réseau cérébro-vasculaire. », explique Nicolas Renier
Pour valider cette méthodologie, l’équipe de chercheurs a collaboré avec l’équipe de Piotr Topilko qui développe des modèles expérimentaux d’accidents vasculaires cérébraux (AVC), pour étudier l’impact d’un AVC, qui correspond à l’obstruction ou à la rupture d’une artère cérébrale, sur la vasculature du cerveau. Ils ont observé une réorientation massive des capillaires sanguins vers le site de l’accident. « Le réseau vasculaire, même dans un cerveau adulte, est extrêmement plastique et peut être l’objet de remaniements très importants. », poursuit Nicolas Renier
Ayant montré que les régions sensorielles étaient les plus densément vascularisées dans le cerveau, les chercheurs, en collaboration avec Nicolas Michalski et Christine Petit de l’Institut Pasteur se sont penchés sur l’effet de la surdité sur le réseau vasculaire cérébral. Ils ont pu mesurer que lors d’une surdité congénitale, la vascularisation des aires auditives est largement diminuée au profit d’une augmentation de la vascularisation des aires cérébrales associées au toucher et à la vision. Une forme de compensation existerait donc entre les différentes aires cérébrales, la communication neuronale entre ces aires influençant la réorganisation du réseau vasculaire.
« Ces données sont très encourageantes et nous poussent à aller explorer d’autres contextes pathologiques dans lesquels l’activité neuronale est affectée. L’outil que nous avons développé permet de faire ces reconstructions à l’échelle du cerveau entier dans différents contextes et ainsi générer des hypothèses nouvelles sur la façon dont diverses maladies modifient la topologie vasculaire. »conclut Nicolas Renier.
Source Mapping the fine scale organization and plasticity of the brain vasculature, Christoph Kirst, Sophie Skriabine, Alba Vieites-Prado, Thomas Topilko, Paul Bertin, Gaspard Gerschenfeld, Florine Verny, Piotr Topilko, Nicolas Michalski, Marc Tessier-Lavigne, Nicolas Renier, Cell, 2020.